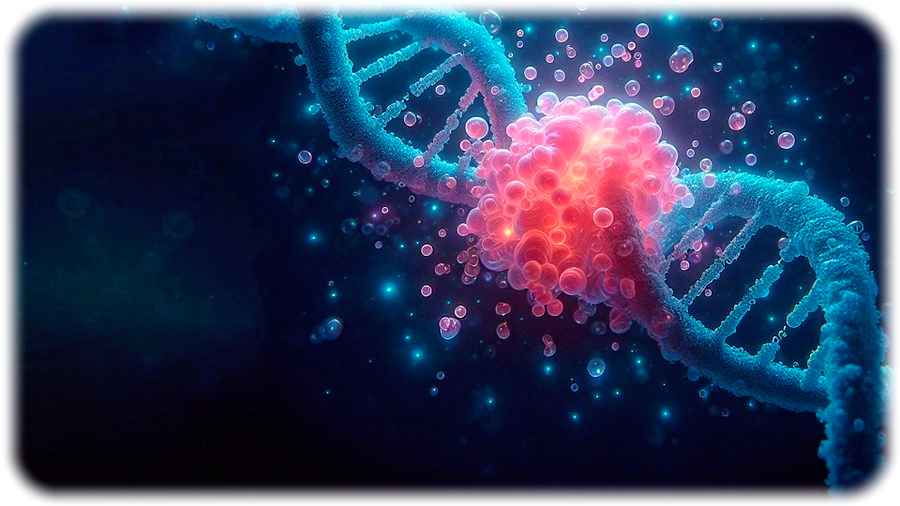
Eine künstlerische Darstellung der Ergebnisse: Die gebrochenen DNA-Enden werden durch den klebrigen Klumpen des Parp1-Proteins zusammengehalten. Visualisierung: Magdalena Gonciarz / Dall-E3
Molekularer Leim „Parp1“ soll für bessere Krebstherapien sorgen
Dresden, 6. Februar 2024. Dresdner Forscher sind den Reparatur-Mechanismen der Erbgut-Moleküle im Menschen ein Stück näher gekommen – und damit auch neuen Ansätzen für künftige Krebstherapien. So hat ein Forscherteam um Prof. Simon Alberti vom „Biotechnologischen Zentrum“ (Biotec) der TU Dresden nun die Funktionsweise und Rezeptur des protein-basierten Reparaturklebers „Parp1“ entziffert, mit denen der Organismus beschädigte DNS-Ketten (englisch: DNA) solange provisorisch kittet, bis die eigentlichen Reparatur-Enzyme ihre Arbeit vollbracht haben. Das geht aus einer Mitteilung der Technischen Universität Dresden (TUD) hervor.
Strahlen, Chemikalien & Co. können Strangbruch auslösen
Hintergrund: Ultraviolett-Licht und andere Strahlung, aber auch Problem-Chemikalien oder freie Radikale können die Desoxyribonukleinsäuren (DNS), die unsere Erbgut-Informationen enthalten, Schäden erleiden – bis hin zum Doppelstrangbruch, bei dem die Kette in zwei Teile bricht. Die Zelle muss dann dafür sorgen, dass die gebrochenen Stränge nicht auseinanderdriften und wieder miteinander verbunden werden können.
Wie ein Ersthelfer am Unfallort
„Wie Zellen die Trennung gebrochener DNA-Enden verhindern, war bisher ein Rätsel“, erklärt Prof. Alberti. „Mein Team hat herausgefunden, dass dies durch ein Protein namens PARP1 vermittelt wird, das schon lange als Sensor für DNA-Schäden bekannt ist. Diesen molekularen „Leim“ kann könne man sich wie einen Ersthelfer am Unfallort vorstellen, der die Unfallstelle absperrt und den Schaden vorerst minimiert. So könnten dann die „molekularen Reparaturarbeiter“ ihre Arbeit in Ruhe verrichten und die gebrochene DNA schnell reparieren: „Einzelne PARP1-Moleküle erkennen den Doppelstrangbruch und verbinden sich miteinander, um eine Art Unterwasser-Sekundenkleber zu bilden, der das Auseinanderfallen der beiden Enden verhindert“, erläutert Prof. Alberti. „Dieser Kleber hält nicht nur die DNA-Enden zusammen, sondern ermöglicht auch DNA-Reparaturenzymen, ihre Arbeit zu verrichten.“
Gezielte Hemmung von Parp1 tötet Krebszellen ab
Die neue Studie liefere wertvolle Erkenntnisse für die Krebsforschung, schätzen die Uni-Forscher ein: „Aufgrund seiner Rolle bei der DNA-Reparatur ist Parp1 bereits Ziel vieler zugelassener Krebstherapien“, betont Simon Alberti. „Die gezielte Hemmung von Parp1 tötet Krebszellen ab. Unsere Arbeit enthüllt die molekulare und physikalische Grundlage dafür, warum diese Krebstherapien so erfolgreich sind. Die Daten deuten auf ein Modell hin, bei dem die Krebsbehandlung den PARP1-Superkleber so beeinträchtigt, dass er an der DNA bleibt. Auf diese Weise würde er Straßensperren für den Replikationsapparat von Krebszellen schaffen und sie zum Zelltod zwingen.“ Wenn Genetiker, Biotechnologen und Mediziner diesen Prozess künftig besser durchschauen, dann lassen sich bessere Therapien gegen Krebs entwickelt und diese auch zielgenauer einsetzen.
Für die Studie hatten die Biotec-Wissenschaftler mit dem Dresdner Exzellenzcluster „Physik des Lebens”, dem Max-Planck-Instituts für molekulare Zellbiologie und Genetik in Dresden, der Heinrich-Heine-Universität Düsseldorf und dem Institut für Molekularbiologie der Bulgarischen Akademie der Wissenschaften zusammen gearbeitet.
Autor: Oiger
Quelle: TUD
Wissenschaftliche Publikation:
„PARP1-DNA co-condensation drives DNA repair site assembly to prevent disjunction of broken DNA ends“ von Nagaraja Chappidi, Thomas Quail, Simon Doll, Laura T. Vogel, Radoslav Aleksandrov, Suren Felekyan, Ralf Kühnemuth, Stoyno Stoynov, Claus A.M. Seidel, Jan Brugues, Marcus Jahnel, Titus M. Franzmann und Simon Alberti, in: „Cell“ (February 2024), Fundstelle im Internet: DOI https://doi.org/10.1016/j.cell.2024.01.015

Ihre Unterstützung für Oiger.de!
Ohne hinreichende Finanzierung ist unabhängiger Journalismus nach professionellen Maßstäben nicht dauerhaft möglich. Bitte unterstützen Sie daher unsere Arbeit! Wenn Sie helfen wollen, Oiger.de aufrecht zu erhalten, senden Sie Ihren Beitrag mit dem Betreff „freiwilliges Honorar“ via Paypal an:
Vielen Dank!


Du muss angemeldet sein, um einen Kommentar zu veröffentlichen.