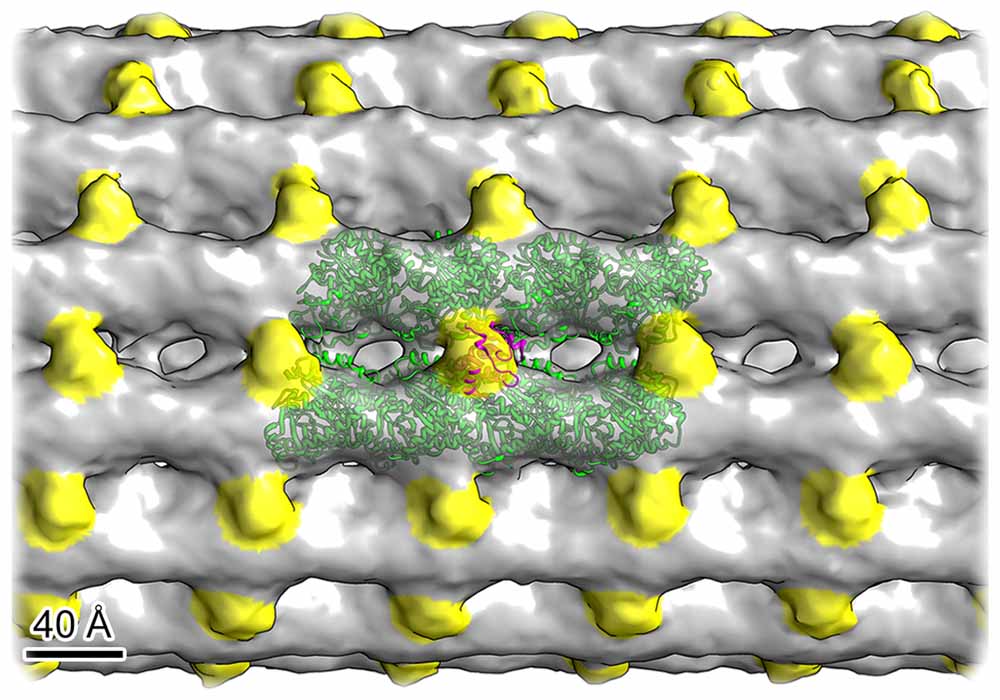
Durch Kälte-Elektronentomographien haben die Forscher das 3D-Modell eines primären Ziliums der Niere erhalten. Gestützt wird diese starre Zellantenne durch Mikrotubuli (grau) mit Zweifach-Molekülketten (Dimere, grün) und Verbindungs-Proteinen (gelb). Abb.: Kiesel u.a. in „Nature Structural & Molecular Biology“ / MPI-CBG
Dresdner Planck-Molekularbiologen entwickeln neues Analyseverfahren
Dresden, 2. Oktober 2020. Wie können Menschen eigentlich sehen, hören und schmecken, obwohl sie weder Mikrophone noch Kamerasensoren wie ein Smartphone haben? Auf einer eher abstrakten, makroskopischen Ebene ist darüber schon viel bekannt. Doch wie genau das eigentlich in der Welt der winzig kleinen Moleküle im Auge, im Ohr oder auf der Zunge praktisch abläuft, ist noch ungenügend erforscht. Offensichtlich spielen für unsere Sinneswahrnehmungen mikroskopisch kleine Zellantennen („Zilien“) eine wichtige Rolle, die auf den meisten Zellen aller Säugetiere entweder beweglich oder fest montiert sind,. Molekularbiologen aus Dresden haben nun eine Methode entwickelt, um die starren Zilien zu analysieren. Das hat Forschungsgruppen-Leiterin Gaia Pigino vom Max-Planck-Institut für molekulare Zellbiologie und Genetik (MPI-CBG) in Dresden mitgeteilt.
Kryo-Elektronentomograph liefert 3D-Modell der Molekülstruktur
„Wir kombinierten eine Abwandlung einer bestehenden chemischen Methode mit einer mechanischen, um die Zilien aus Nierenzellendirekt auf dem Mikroskopie-Träger zu isolieren“, erklärte Laborassistentin Petra Kiesel aus der Forschungsgruppe Pigino. Danach konnten sie die tiefgefrorenen Zellantennen in einen Kryo-Elektronentomographen eingelagen, der dann 3D-Computer-Modelle ihrer Molekularstruktur für weitere Analysen erzeugt hat.
Weg für weitere Analysen geebnet
Die festen Zellantennen werden demnach von einem etwas unregelmäßigen Zyto-Skelett aus mikroskopisch kleinen Röhrchen (Mikrotubuli) gestützt und enthalten fadenförmige Strukturen aus dem Protein „Aktin“ (Aktinfilamente). Wie genau sie Signale aus der Zellumgebung aufnehmen und mit anderen Zellen Signale austauschen, ist Gegenstand weiterer Auswertungen, die durch das neue Analyse-Verfahren aus Dresden möglich geworden sind.
Kaputte Zellantennen können Menschen das Augenlicht nehmen und sie herzkrank machen
„Unsere Methode wird den Weg für viele tief greifende Untersuchungen der primären Zilien ebnen und es uns im Umkehrschluss ermöglichen, diese wichtigen Organellen bei Tier und Mensch hinsichtlich Gesundheit und Krankheit besser zu verstehen“, ist Gruppenleiterin Gaia Pigino überzeugt. Denn vieles deutet darauf hin, dass Fehlfunktionen der Zellantennen zahlreiche menschliche Krankheiten mitverursachen können, beispielsweise Netzhautdegeneration, bestimmte Nierenerkrankungen, das Bardet-Biedl-Syndrom oder Herzerkrankungen. Wenn die Mediziner nun neue Erkenntnisse darüber gewinnen, wie die unbeweglichen Zilien auf molekularere Ebene eigentlich funktionieren, könnte dies auch den Schlüssel für neue Therapien liefern.
Autor: Heiko Weckbrodt
Quellen: MPI-CBG, Wikipedia
Die wissenschaftliche Publikation dazu:
Petra Kiesel, Gonzalo Alvarez Viar, Nikolai Tsoy, Riccardo Maraspini, Peter Gorilak, Vladimir Varga, Alf Honigmann, Gaia Pigino: „The molecular structure of mammalian primary cilia revealed by cryo-electron tomography”, Nat Struct Mol Biol, 28. September 2020. Doi: 10.1038/s41594-020-0507-4
Zum Weiterlesen:
Planck-Genetiker wollen Superkräfte der Fledermaus entschlüsseln
Dresdner Netzhaut-Forscher ausgezeichnet

Ihre Unterstützung für Oiger.de!
Ohne hinreichende Finanzierung ist unabhängiger Journalismus nach professionellen Maßstäben nicht dauerhaft möglich. Bitte unterstützen Sie daher unsere Arbeit! Wenn Sie helfen wollen, Oiger.de aufrecht zu erhalten, senden Sie Ihren Beitrag mit dem Betreff „freiwilliges Honorar“ via Paypal an:
Vielen Dank!


Du muss angemeldet sein, um einen Kommentar zu veröffentlichen.