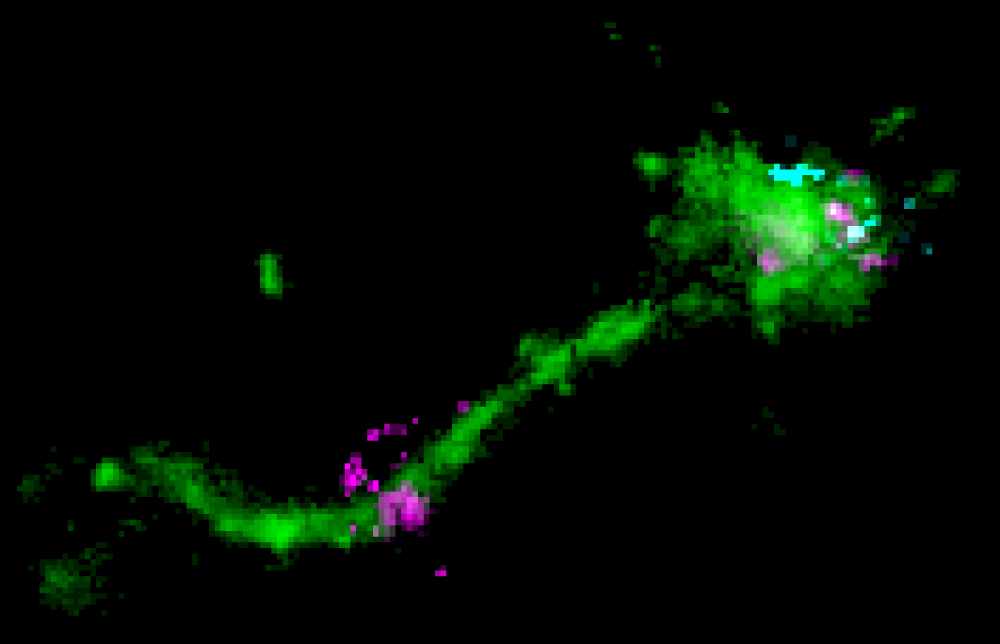
Ein Nano-Fettpartikel befindet sich auf einem langen endosomalen Tubulus (grün),
zusammen mit einem senkrecht verlaufenden mRNA-Signal (cyan). Das Bild zeigt
wahrscheinlich ein Entkommen von mRNA (lila). Abb.: Marino Zerial / MPI-CBG
Forscher aus Sachsen und England arbeiten an Entzifferung der richtigen Zieladressen für Fettkügelchen mit Gentech-Impfstoffen an Bord
Dresden/Cambridge, 7. Dezember 2021. Dresdner Forscher suchen gemeinsam mit dem britischen Pharmakonzern „Astrazeneca“ aus Cambridge nach neuen, niedrig dosierten hund gut verträglichen Gentech-Impfstoffen, die nicht nur für den Kampf gegen Infektionskrankheiten wie Corona, sondern auch gegen Krebs eingesetzt werden können. Dafür entschlüsseln sie derzeit die Wege, auf denen Boten-Ribonukleinsäure (mRNA) in menschlichen Zellen am effizientesten freigesetzt werden können. Das geht aus einer Mitteilung des Max-Planck-Instituts für Zellbiologie und Genetik (MPI-CBG) aus Dresden hervor.
Transport per Fettkugel
mRNA-Impfstoffe und -Medikamente sind eine noch junge Technologie, die vor allem durch die rasch entwickelten Corona-Impfstoffe bekannt geworden sind. Solche Vakzine schleusen speziell designte Kopierwerk-Boten – eben die mRNA – mit Hilfe von schützenden Fettkügelchen (Lipid-Nanopartikel = LNPs) in die Zellen des Patienten ein. Dort sorgen sie für den Aufbau bestimmter Proteine, die das Immunsystem auf geeignete Abwehrmaßnahmen gegen die jeweilige Krankheit trainieren sollen.
Nur kleiner Teil der Boten-RNA wirkt tatsächlich
Das Team um MPI-CBG-Direktor Marino Zerial geht nun gemeinsam mit Astrazeneca der Frage nach, warum nur ein kleiner Teil der gespritzten mRNA auch wirklich wirksam wird. „Um in die Zelle zu gelangen, muss mRNA einen langen Weg zurücklegen. In den fettigen LNP-Tröpfchen eingeschlossen, muss sie zunächst erst einmal in die Zelle hinein“, erklärt Marino Zerial. „Die LNPs erreichen die Zelloberfläche, wo sie an Rezeptoren binden. Anschließend werden sie in Endosomen aufgenommen, spezielle Organellen, die von einer Membran umschlossen sind. Zu diesem Zeitpunkt befindet sich die mRNA innerhalb der Zelle, ist aber von zwei Barrieren umgeben: dem Fetttröpfchen und der Endosomen-Membran. Die Herausforderung für die mRNA besteht darin, beide Barrieren zu überwinden, um in das Zytoplasma zu gelangen, wo sie als Vorlage für die Herstellung von Proteinen dient. Wir wissen, dass nur ein winziger Bruchteil der mRNA-Moleküle in das Zytoplasma entweichen kann.“
Nicht jedes zellulare Logistikzentrum ist zielführend
Die Forscher haben bereits erkannt, dass sich nur bestimmte „Logistikzentren der Zellen“ (Endosomen) als Zieladresse wirklich eignen. Steuern die Fettkügelchen dagegen sogenannte „späte Endosomen“ an, kann dort die mRNA gar nicht mehr entweichen. „Das LNP-Transportsystem für mRNA benötigt aufgrund der geringen Effizienz, mit der die mRNA aus den Endosomen entkommen kann, eine hohe Dosierung“, betont Marino Zerial. „Wenn wir wissen, wohin die mRNA transportiert wird und wie sie den Endosomen entkommen kann, können wir bessere Transportmittel für eine effizientere Freisetzung bei geringerer Dosierung entwickeln. Wir können das mRNA-Transportsystem so verbessern, dass es für viele therapeutische Anwendungen, zum Beispiel zur Behandlung von Krebs, eingesetzt werden kann.“
Quelle: MPI-CBG
Wissenschaftliche Publikation:
Prasath Paramasivam, Christian Franke, Martin Stöter, Andreas Höijer, Stefano Bartesaghi, Alan Sabirsh, Lennart Lindfors, Marianna Yanez Arteta, Anders Dahlen, Annette Bak, Shalini Andersson, Yannis Kalaidzidis, Marc Bickle, and Marino Zerial: “Endosomal escape of delivered mRNA from endosomal recycling tubules visualized at the nanoscale, J Cell Biol (2021): e202103003, doi: 10.1083/jcb.202110137

Ihre Unterstützung für Oiger.de!
Ohne hinreichende Finanzierung ist unabhängiger Journalismus nach professionellen Maßstäben nicht dauerhaft möglich. Bitte unterstützen Sie daher unsere Arbeit! Wenn Sie helfen wollen, Oiger.de aufrecht zu erhalten, senden Sie Ihren Beitrag mit dem Betreff „freiwilliges Honorar“ via Paypal an:
Vielen Dank!

Du muss angemeldet sein, um einen Kommentar zu veröffentlichen.